一、蛋白质电泳原理介绍
生物大分子如蛋白质、核酸、多糖等常以颗粒分散在溶液中,它们的净电荷取决于介质的H+浓度或与其他大分子的相互作用。在电场中,带电颗粒向阴极或阳极迁移,迁移的方向取决于它们带电的符号,这种迁移现象即电泳。
以淀粉胶、琼脂或琼脂糖凝胶、聚丙烯酰胺凝胶等作为支持介质的区带电泳法称为凝胶电泳。聚丙烯酰胺凝胶电泳是以聚丙烯酰胺凝胶作为支持物的一种电泳方法,人为控制聚丙烯酰胺凝胶聚合成孔径的大小,通过类似分子筛的作用把蛋白质分开。它有两种形式:非变性聚丙烯酰胺凝胶电泳(Native-PAGE)和SDS-聚丙烯酰胺凝胶(SDS-PAGE)。
非变性聚丙烯酰胺凝胶电泳(Native-PAGE),在电泳的过程中,蛋白质能够保持完整状态,并依据蛋白质的分子量大小、蛋白质的形状及其所附带的电荷量而逐渐呈梯度分开。
SDS-聚丙烯酰胺凝胶(SDS-PAGE)仅根据蛋白质亚基分子量的不同就可以分开蛋白质。SDS是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。而强还原剂如巯基乙醇,二硫苏糖醇能使半胱氨酸残基间的二硫键断裂。在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白- SDS胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。蛋白质的迁移率仅取决于蛋白质的分子质量的大小。与已知分子质量的标准品比较,可以测定蛋白质的分子质量。
二、SDS-聚丙烯酰胺凝胶电泳系统介绍
1.聚丙烯酰胺基质
电泳的早期形式,即在自由溶液中进行的移动界面电泳已成为历史,代之以采用支持介质的区带电泳现在被广泛的使用。采用支持介质的目的是防止电泳过程中的对流和扩散,以使被分离的成分得到最大分辨率的分离。支持介质应具备以下特征:化学惰性,不干扰大分子的电泳过程,化学稳定性好,均匀,重复性好等。固体支持介质可分为两类:一类是如纸、醋酸纤维素膜、硅胶、纤维素等。另一类是如淀粉、琼脂糖和聚丙烯酰胺凝胶等。目前,第一类支持介质已逐渐被第二类支持介质所替代。其中,聚丙烯酰胺凝胶,由于它的高分辨率,已成为目前生化实验室最常用的支持介质。
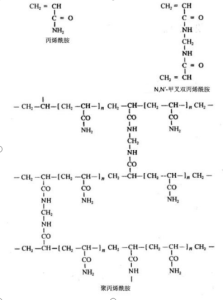
聚丙烯酰胺凝胶(polyacrylamide gel,PAG)是由单体丙烯酰胺(acrylamide,简称Acr)和交联剂N,N’-甲叉双丙烯酰胺(N,N’-methylenebisacrylamide)在催化剂和加速剂作用下聚合交联而成的三维网状结构的凝胶。一般用于蛋白质电泳的凝胶选用29:1的丙烯酰胺与N,N’-甲叉双丙烯酰胺的混合物,以过硫酸铵作为引发剂进行聚合。
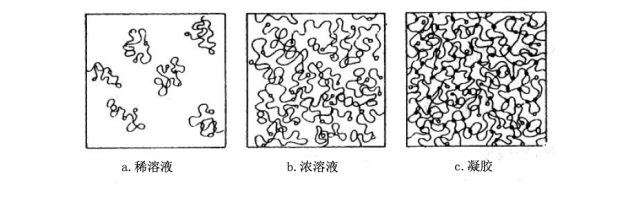
2.连续电泳和不连续电泳
连续电泳是指电泳系统使用相同孔径的凝胶和相同缓冲系统的样品缓冲液、凝胶缓冲液和电极缓冲液,且pH值恒定,只是离子强度不同的区带电泳。使用这种电泳系统分离蛋白质,由于分子筛效应不明显,一般只用于分离组分比较简单的样品,且没有堆积胶的浓缩作用,分辨率较低,加样时必须加成一条极窄的带,以使样品能够很好的分离。如果高分辨率不是目的,用这种方法制胶快而简单。它的另一个优点是在均一系统的电泳中,pH是恒定的,这对分离pH敏感的化合物是有利的。可以防止蛋白样品进入凝胶后,由于pH的变化而发生凝聚和沉淀。
不连续电泳是指使用不同孔径和不同缓冲系统的电泳。由于堆积胶的浓缩作用,可使样品(即使是稀样品)在浓缩胶和分离胶的界面上先浓缩成一窄带,然后在一定浓度(或一定浓度梯度)的凝胶上进行分离。由于不同孔径凝胶的分子筛作用,使不连续电泳的分辨率大大高于连续电泳。虽然不连续电泳在缓冲系统的选择和制胶(尤其是梯度胶)的操作方面比较繁杂,但它可以得到电泳分离最重要的指标——高分辨率,因而是目前应用最广泛的技术。
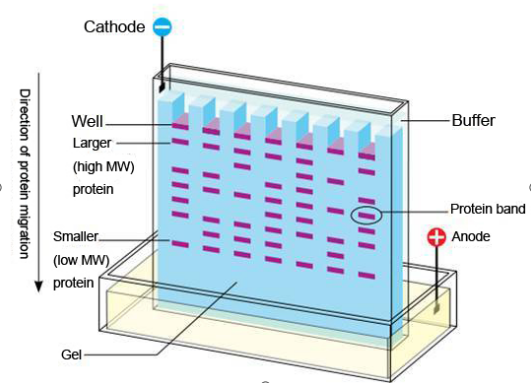
3.浓缩胶和分离胶
凝胶由两种不同的凝胶层组成,上层为浓缩胶,下层为分离胶。浓缩胶(concentrating gel)又称堆积胶(stacking gel),凝胶浓度相对较小,孔径相对较大。把样品加在浓缩胶上,经过大孔径凝胶的迁移作用而被浓缩至一个狭窄的区带。分离胶(separation gel, resolving gel)又称电泳胶(running gel),孔径通常较小,通过选择合适的凝胶浓度,使样品组分得以很好的分离。分离胶又可分为固定胶和梯度胶。
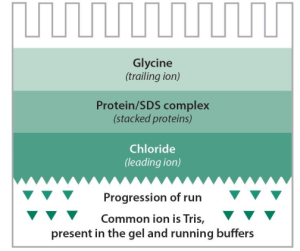
其作用原理如下, 以Tris-甘氨酸系统为例,浓缩胶pH6.7,分离胶pH8.9。在浓缩胶中HCL几乎全部解离为CL–,但只有极少部分甘氨酸解离为H2NCH2COO–。蛋白质的等电点一般在pH5左右,在此条件下其解离度在HCL和甘氨酸之间。当电泳系统通电后,这3种离子都向阳极移动。其有效泳动率依次为CL–>蛋白质>H2NCH2COO–,故CL–称为先导离子,H2NCH2COO–称为尾随离子。电泳开始后,由于先导离子的泳动速率最大,就会很快超过蛋白质,因此在先导离子后面,形成一个离子浓度低的区域,这时就有了较高的电位梯度。这种高电位梯度使后面蛋白质和尾随离子在先导离子后面加快移动。当先导离子、蛋白质和尾随离子的泳动速率相同时,建立一种稳定状态,这时在先导离子和尾随离子之间形成一个稳定而又不断向正极移动的界面。当移动的界面到达浓缩胶和分离胶界面时,凝胶的pH明显增加,尾随离子甘氨酸大量解离为负离子,泳动速率加快,很快超过蛋白质,高电压梯度随即消失。同时,由于凝胶孔径变小,使蛋白质分子的迁移率减小。于是,蛋白质分子在均一的电压梯度和pH中泳动,并根据其固有的带电性和分子大小进行分离。
三、聚丙烯酰胺凝胶电泳体系介绍
1.Tris-Glycine体系(Laemmli体系)
①传统的体系②先导离子:氯阴离子③尾随离子:甘氨酸离子④反向离子:Tris阳离子⑤工作PH:9.5。
2.Bis-Tris体系
① Future PAGE™蛋白预制胶使用的体系②先导离子:氯阴离子③尾随离子:MOPS或MES离子④反向离子:Bis-Tris阳离子⑤工作PH:7.0。

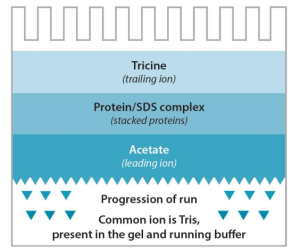
3.Tris-Acetate或HCl(Tricine)体系
①用于对过大或过小的蛋白(多肽)分离②先导离子:乙酸根阴离子或氯阴离子③尾随离子:Tricine离子④反向离子:Tris阳离子⑤工作PH:8.1或9.5。
You need to be registered and logged in to take this quiz. Log in or Register



