

②NC膜适用于各种显色方法,包括同位素,化学发光、常规显色、染色和荧光显色;背景低,信噪比高。NC膜的使用也很简便,不需要甲醇预处理,只要在无离子水中浸润,排出膜内气泡,再在转膜缓冲液中平衡几分钟就可以正常实验。
③硝酸纤维素膜(NC膜)的结合能力主要与膜的硝酸纤维素的纯度有关,注意选择纯的NC膜,混有含醋酸纤维(CM)的NC膜结合力会有所降低,但是纯的NC膜比较脆,又容易卷,操作要小心,不适合多次重复清洗。
④实验时注意选择合适的孔径,通常20KD以上的大分子蛋白用0.45um孔径的膜,小于20KD的蛋白建议选择0.2um孔径的膜,如果小于7KD的话最好选择0.1um孔径的膜。
2.聚偏二氟乙烯膜(PVDF膜)
①聚偏二氟乙烯膜(PVDF膜)是一种高度疏水的固相支持物,在水溶液中不会浸湿, PVDF膜在使用时需预处理,一般用100%甲醇处理,目的是活化膜上的正电基团,使其更容易与带负电的蛋白结合,经预处理的膜可以直接放入转膜缓冲液中平衡。
②PVDF膜的蛋白截留能力、机械耐受强度、化学相容性都比NC膜更有优势,适用于各种染色应用和多重免疫检测,特别是用于做N端蛋白测序。
③PVDF 膜典型结合量是 100-200ug/cm2(结合强度 PVDF 比硝纤膜强 6 倍)。通常20KD以上的大分子蛋白用0.45um孔径的膜,小于20KD的蛋白建议选择0.2um孔径的膜。
④相对地,PVDF膜比NC膜背景信号要更高,此外,从经济上来说,PVDF膜的价格更昂贵。
蛋白转移的方法多用电泳转移,它又有半干法和湿法之分:
1.湿转移,是最佳转移方法,把滤纸-凝胶-膜-滤纸“三明治”完全浸入缓冲液中,通常使用含有冷却的20%甲醇的转移缓冲液。
2.半干转移,是指将浸满缓冲液的滤纸-凝胶-膜-滤纸“三明治”系统,置于本应干燥的阳极和阴极板上。相较于湿转移所需缓冲液更少,但是在某些情况下会产生更高的背景染色。
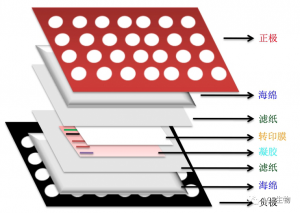
转膜后,可采用丽春红染色方法检测转膜效果。
丽春红带负电,可以与带正电的氨基酸残基结合,同时,丽春红也可以与蛋白的非极性区域相结合,从而形成红色的条带。丽春红对蛋白的染色是可逆的,染色后可以用蒸馏水、PBS或其他适当的溶液洗去,从而进行后续WB实验。
如果没有建议稀释倍数,可参照1:100-1:5000的稀释倍数进行预实验,选择合适的稀释倍数,一抗浓度过高容易产生非特异性条带。
一抗的孵育时间可从数小时至过夜不等(一般不超过18h),具体取决于抗体与蛋白的亲和性和蛋白的丰度。建议使用较高的抗体稀释倍数和较长的孵育时间来保证抗体与蛋白的特异性结合。
如果在封闭液中孵育过夜,尽量在4 ℃中进行。否则容易污染并导致蛋白降解(特别是磷酸基团)。孵育一抗时需要保持适当的摇动使之均匀覆盖膜,防止结合不均匀。
2.二抗的孵育
一抗孵育结束后,用TBST摇动洗膜数次,每次5min,去除残留的一抗。
通常按照抗体说明书中推荐的稀释倍数,用1×TBST稀释二抗。亦可用封闭剂稀释二抗,封闭剂可能会阻碍抗体与目标蛋白结合,从而在降低背景的同时导致特异性条带信号减弱。
如果没有建议稀释倍数,可参照1:1000-1:20000的稀释倍数进行预实验,选择合适的稀释倍数,二抗浓度过高也会产生非特异性条带。
二抗通常带有不同的标记物,WB中常选用酶标二抗,如HRP(辣根过氧化物酶)或AP(碱性磷酸酶)等。推荐使用HRP标记二抗,相对于AP标记二抗,其灵敏度更高。
酶促反应可以搭配不同的底物从而实现不同的显色方法:化学发光和底物显色。HRP 是最常见的酶促发光或显色的交联酶,由于HRP比活高、特异性更强、分子量小(40kD)、稳定和作用底物范围广的优点而得到广泛使用。
HRP的底物种类有不少,主要可以分为化学发光底物和生色底物2大类。HRP的生色底物显色有DAB,4-CN ,CN/DAB,AEC和TMB等,其显色原理主要是利用底物在有HRP和过氧化氢的存在下失去电子而呈现出颜色变化积累这一过程检测WB的结果。最常见的底物DAB可以和HRP作用形成褐色不溶性产物,灵敏度高,特异性好,缺点就是需要现配现用,显色后光照数小时会褪色,不能永久保存,需要拍照记录,而且有毒。
Luminol是经典的HRP化学发光底物。
化学发光底物主要考虑的是:发光信号强弱、发光信号持续的时间,还有就是背景低灵敏度高。化学发光法由于仅在酶和底物都存在的时候才会发光,不同于生色反应般形成不溶的产物于膜上累积,所以特别适合同一张膜对不同的目标蛋白分别进行多次检测。目前最高检测灵敏度已经达到低飞克(Femto)级别而成为安全且灵敏度最高的WB检测方法。

相关产品推荐:
1,FuturePAGEᵀᴹ 蛋白预制胶 链接:新品上市 | FuturePAGEᵀᴹ 蛋白预制胶
2,ECL Basic ECL Enhanced ECL Super鲁米诺化学发光试剂盒




