蛋白定量是蛋白分离和分析前必须的一个重要步骤,蛋白色谱分离、蛋白质电泳分析、蛋白质免疫分离和分析、细胞裂解释放的总蛋白定量、蛋白分子的标记、蛋白结构分析等,都需要可靠的定量分析作为基础。蛋白定量分析应用的领域包括生物科学,食品检验,临床检验等等。
每种蛋白定量方法都有其局限性,而这取决于应用和分析的特定蛋白本身。在选择蛋白定量方法时,需要考虑的特性是:灵敏度(较低的检测限)、与样品中常见物质的相容性(例如,去污剂剂、还原剂、抑制剂、盐和缓冲等)、标准曲线的线性度和蛋白质间的差异。
下面我们介绍几种常用的定量方法
蛋白定量常使用的方法是比色法,通常用于总蛋白的定量分析。根据蛋白和比色试剂的结合,可以将比色法分为:蛋白-染料结合法和蛋白-铜螯合化学试剂法。
前者对应的典型蛋白定量比色法是考马斯亮蓝G250染料结合法,后者则包括双缩脲法,Lowry法,二喹啉甲酸(BCA)法。
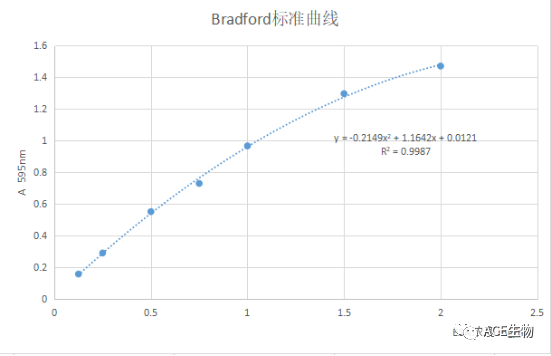
1、 Bradford法
考马斯亮蓝G250染料结合法首次由Marion Bardford博士在1976年提出,因此也叫Bradford法,原理是蛋白在酸性条件下和考马斯染料结合,染料的最大吸收值发生改变,从465nm转移为610nm,并且在595nm处有最大的吸收差异。结合到蛋白质分子上的染料数与蛋白所带正电荷成正比,因此可以用该方法来对蛋白进行定量。染料的颜色变化和蛋白中的碱性氨基酸(精氨酸、赖氨酸和组氨酸)有关,另外范德华力和疏水作用也会影响蛋白与染料的结合。
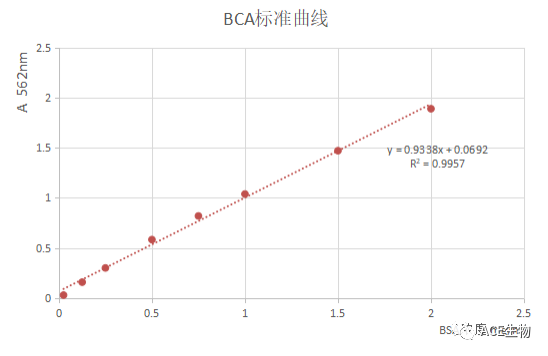
2、 BCA法
1985年Paul K. Smith等人开发出BCA方法,该方法分为两步:首先,在碱性条件下,蛋白将二价铜离子还原为一价铜离子,然后,BCA和一价铜离子结合,形成紫色化合物,该化合物在562nm时有最大吸收,且吸收值与蛋白浓度呈线性相关。
紫外法也是常用的蛋白定量方法之一,该方法在简单的分光光度计中就可以定量测定溶液中蛋白质的含量。蛋白质对近紫外光的吸收依赖于酪氨酸(Tyr)和色氨酸(Trp)含量,同时在很小的程度上也会受到苯丙氨酸(Phe)和二硫键数量的影响。因此,蛋白质之间A280的吸收值相差很大,对于浓度为1 mg/mL的溶液,从0到4的数值都有,大多蛋白的吸收值在0.5 – -1.5的范围之间。
三种方法的优缺点比较




