ACE免疫沉淀/免疫共沉淀试剂盒

小白必看——实验操作详解
Q1:磁珠法IP/CO-IP试剂盒有两种,我该怎么选?
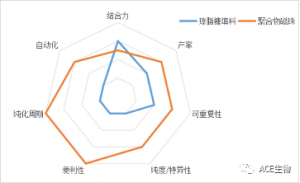
图1.不同基质微球的对比
Q2:说明书上提供了两种实验方案,我该如何选择?
免疫沉淀(IP)主要针对的是纯化单一抗原的实验。抗原-抗体复合物的组合既可以分步进行, 也可以一步完成。下面提供两种常用的孵育方案:
方案一,先将抗体和样品 ( 如细胞裂解物 ) 混合孵育, 然后加入亲和用微球, 结合抗体-抗原复合物。
方案二,先将抗体和亲和微球先进行孵育结合,然后加入含有抗原的样本,依靠亲和微球-抗体复合物来捕获目标抗原。
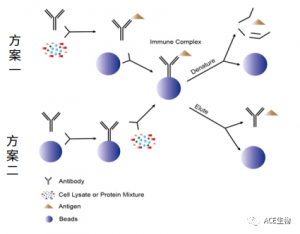
图2. 两种方案IP操作流程示意图
Q3:我要做Co-IP实验,说明书中只介绍了IP操作的步骤,我应该怎么做?
免疫共沉淀分析(Co-IP)与IP十分相似,实验的方案和基本流程与IP相同,当制备好亲和微球-抗体-抗原复合物后,可以加入待测样品混合孵育,基本上所有IP的体系均可以用于 Co-IP。
Q4:一次实验需要准备多少样品量?
一次实验亲和微球的用量是20ul,能结合的抗体量是5ug左右,细胞裂解液的体积在200-500ul。细胞量的选择及裂解浓度在说明书中有详细介绍。
Q5:酸性洗脱和变性洗脱有什么区别?
酸性洗脱后立即中和,对获得的目的蛋白活性影响较小,除可以用于SDS-PAGE实验,也可用于质谱等分析实验。
变性洗脱获得的蛋白失活,一般只用于SDS-PAGE实验及后续银染或者WB等验证。注:不同洗脱方式获得样品状态见上图2。
大神进阶——实验结果分析
Q1:我的input上有目的蛋白,为什么实验组没有明显条带?(下图3)

图3
实验组没有目的蛋白可能有以下几个原因:
1. 抗体未结合在亲和微球上,建议按方案一操作,增加抗体与微球的孵育时间。
2. 抗原未与抗体结合,用1×IP Lysis/Wash Buffer 稀释裂解后的样品来降低去污剂的浓度,同时增加孵育时间。
注:孵育时需要让亲和微球在样品溶液中保持悬浮状态,微球沉底也会对结合效率有影响。
3. 洗脱不彻底,选择变性洗脱方式。
Q2:微球是不是有非特异性吸附,WB的背景非常深?(下图4)
图4
亲和微球的非特异性吸附可以通过增加清洗微球的1×IP Lysis/Wash Buffer(Enhanced)体积,或者是在磁珠漂洗步骤更换新EP管来优化。
WB背景深可能是在一抗二抗孵育后清洗步骤不彻底造成的,可以适当提高清洗时摇床的转速,7.5%奶粉溶液也需要提前配制,充分溶解。
Q3:我的目的蛋白条带和抗体的重链/轻链分子量接近,WB上无法判断。
一般IP实验中的抗体和WB实验中的一抗要选择不同种属的抗体,这样才能避免曝光出抗体条带;如果选择同一种属的抗体,WB实验中的二抗也可选择避免轻链/重链的二抗。
以上就是小编总结的一部分IP实验及后续WB验证中常见的问题,希望能给广大客户的完美实验锦上添花。
ACE将努力成为客户实验中的得力助手,帮助每一位客户完成从小白到大神的完美蜕变!



